2021.01.28
- 連載
- 病気のこと
- 医療
ALSの免疫療法
滋賀医科大学 内科学講座 脳神経内科 教授
漆谷 真 先生
連載 ALS研究者インタビュー「未来を拓く」vol.2
漆谷 真 先生

漆谷 真 先生
ALSの免疫療法とは、脳に溜まった「異常構造を持つタンパク質」の分解・除去を目指した治療法で、現在、さまざまな技術を用いて、動物実験等による研究段階に進みつつあります。
今回は、将来、ALS治療の一端を担うと期待されるALS免疫療法について、その研究背景と現状を紹介します。
- 目次
体内の“異物を攻撃する力”を用いる免疫療法
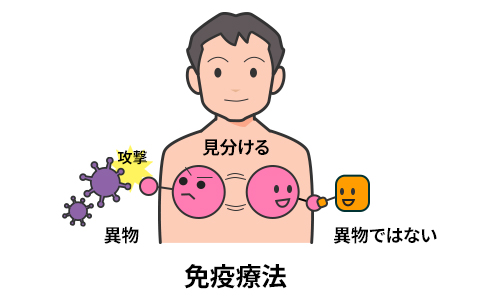
免疫療法とは、私たちの体に予め備わっている、ウイルスやがん細胞などの異物を攻撃する免疫システムを利用したもの(図1)で、代表的なものに、インフルエンザワクチンやがん免疫療法の抗体などがあります。
今回ご紹介するALSを始めとした、アルツハイマー型認知症、パーキンソン病など、神経に変性が生じる病気では、「異常構造を持つタンパク質」が異物となります。
神経に変性が生じる病気の多くでは、脳に「異常構造を持つタンパク質」が蓄積し、それが原因となって病気になることがわかってきています1) 。
Tanaka K, Matsuda N. Biochem Biophys Acta. 2014, 1843(1): 197-204.
「異常構造を持つタンパク質」はなぜ生じる
タンパク質は、多くのアミノ酸が遺伝子の設計図通りに繋がった後、各アミノ酸の性質にしたがって自然に折り畳まれ、複雑な立体構造を形成します。
しかし、タンパク質を作る遺伝子に変異がある場合は、アミノ酸の一部が異なる異常タンパク質が作られてしまい、正常ではない「異常構造を持つタンパク質」となってしまいます(図2-①)。
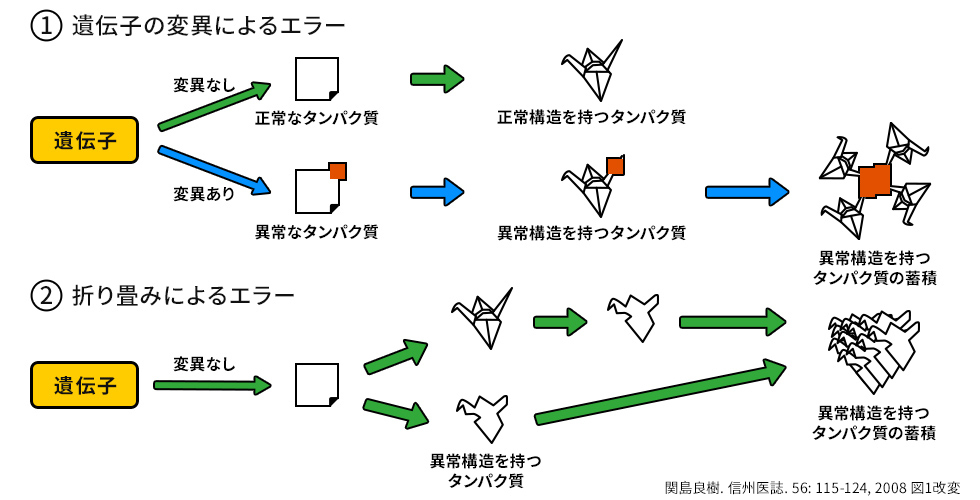

また、アミノ酸の数が非常に多い、大きなタンパク質の場合、稀に折り畳みにエラーが起こって「異常構造を持つタンパク質」になってしまうこともあります(図2-②)2) 。
これらのタンパク質が作られても、体内で速やかに分解・除去されれば、特に問題は生じません。
しかし、何らかの理由で分解されることなく、どんどん溜まってしまうと、病気を引き起こしてしまうのです。
2)Dobson CM. Nature. 2003, 426(6968): 884-890.
ALSにおける「異常構造を持つタンパク質」の発見
長らく原因不明で、手がかりすらなかったALSの研究は「異常構造を持つタンパク質」の発見によって新しい局面を迎えました。
1993年、家族性*ALSの患者さんで、SOD1というタンパク質の遺伝子に変異があることが発見されました3) 。
家族性ALS患者さんの20~35%の方が、この遺伝子変異を持っており、異常構造を持つSOD1タンパク質の蓄積が病因と考えられています4) 。
*ALS患者さんの5~10%は家族歴のある「家族性ALS」であり、90~95%は遺伝による発症でない「孤発性ALS」です。
また、2006年には孤発性ALSの患者さんで、異常構造を持つTDP-43というタンパク質が発見されました5, 6)。
孤発性ALS患者さんの97%の方に、 この折り畳みエラーによる「異常構造を持つタンパク質」が認められています7)。
SOD1もTDP-43も本来は生命活動に必要なタンパク質です。
しかし、タンパク質の構造が異常となると、本来の役割を果たすことができなくなるだけでなく、蓄積したタンパク質が神経細胞にダメージを与えてしまうのです。
3)Rosen DR et al. Nature. 1993, 362(6415):59-62.
4)Nakamura R et al. Neurobiol Aging. 2016, 39: 219.e211-218.
5)Arai T et al. Biochem Biophys Res Commun. 2006, 351(3): 602-611.
6)Neumann M et al. Science. 2006, 314(5796): 130-133.
7)Ling SC et al. Neuron. 2013, 79(3): 416-438.
標的タンパク質は、細胞の中か?外か?
免疫療法の開発を行うにあたっては、まず標的となる「異常構造を持つタンパク質」の居場所を突き止める必要があります。
標的タンパク質が、細胞内に留まる場合、そのアプロ―チには技術的な難しさが存在します。抗体分子を細胞内に入れる技術が、まだ確立されていないためです(図3)。
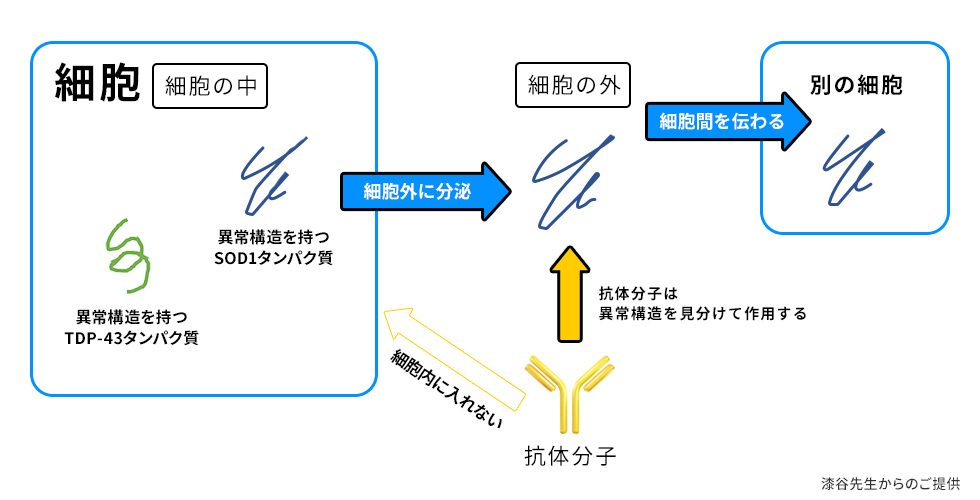
ALSに先行して、アルツハイマー型認知症の研究が進んでいた理由の一つに、標的タンパク質(アミロイドβ)の細胞外分泌が判明8)していたことがあります。
そこで、ALSの免疫療法でもまず、SOD1で「異常構造を持つタンパク質」が細胞外に出てくるのかどうか、ALSモデルマウスを用いて調べたところ、あるタンパク質と結合することによって、細胞外に分泌されることがわかりました9)。
また、SOD1では「異常構造を持つタンパク質」が近くにある細胞にも伝わって、病気を進行させていくこともわかってきました10, 11)。
これらのことから、SOD1を標的とした研究では、すでに確立されている、細胞外の異物を狙った抗体技術を用いて進められていきました。
一方、TDP-43では研究の報告数が少なく、実験系の影響などもあって、細胞外分泌されるのかどうか、結論は出ていません。
8)Glenner GG, Wong CW. Biochem Biophys Res Commun. 1984, 120(3): 885-890.
9)Urushitani M et al. Nat Neurosci. 2006, 9(1): 108-118.
10)Grad LI et al. Proc Natl Acad Sci USA. 2011, 108(39): 16398-16403.
11)Ayers JI et al. Acta Neuropathol. 2016, 131(1): 103-114.
SOD1を標的とした免疫療法の現状
ALSの免疫療法の開発は、まずSOD1を標的として始まりました。
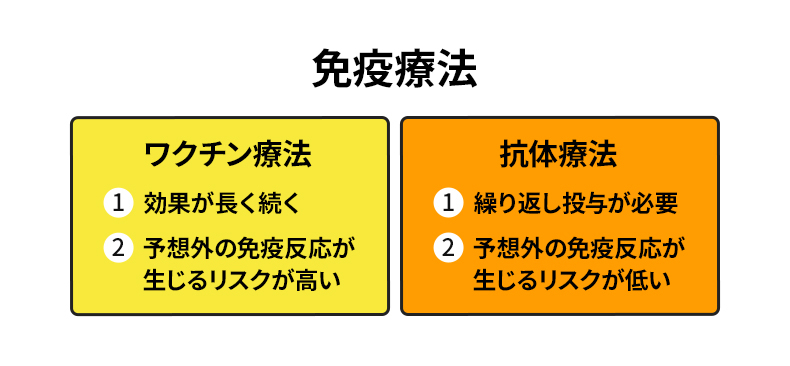
免疫療法はワクチン療法と抗体療法に大別され、各々一長一短があります(図4)。
SOD1の研究でも、ワクチン療法、抗体療法の両方で研究が進められました12)。
ワクチン療法では、標的となる物質の一部(抗原)を注射して患者さん自らの免疫の働きで抗体(抗原のみを攻撃する分子)を作ります。
自分の免疫システムが抗体を作るため、感染症などの予防接種と同じように効果が長続きすることが期待できます。ただし、自然な免疫の働きにゆだねるため、期待通りに抗体ができて適度に働くとは限りません。予想外の免疫反応が生じるリスクもあります。
さらに、神経に変性が生じる病気では、異常タンパク質ではなく、正常なタンパク質を攻撃してしまう可能性も否定できません。
ALSに先行して研究が進んでいたアルツハイマー型認知症によるワクチン療法では、残念ながら安全性の面で開発が2002年に断念され13)注1)、抗体療法にシフトしました。
これを受けて、ALSでも、研究は抗体療法へとシフトしました。
注1)現在、安全性を考慮した新たなワクチン療法の開発が進められ、動物実験の段階に進んでいます。Hara H et al. J Alzheimers Dis. 2016, 54: 1047-1059.
抗体療法は、標的となる異物を間違いなく攻撃する抗体分子をデザインし、体内に入れるため、期待された効果が出る可能性が高く、ワクチン療法のような予想外の免疫反応によるリスクは低くなります。
さらに、抗体には正常なタンパク質と異常タンパク質の構造を見分けられるという利点もあります。
現在、さまざまな研究が進められており、いくつかの抗体で動物実験の段階まで進み、次の臨床段階に進めばと期待されています。14-17)。
12)Urushitani M et al. Proc Natl Acad Sci USA. 2007, 104(7): 2495-2500.
13)Ferrer I et al. Brain Pathol. 2004, 14(1): 11-20.
14)Patel P et al. Mol Ther. 2014, 22(3): 498-510.
15)Liu HN et al. J Neurosci. 2012, 32(26): 8791-8799.
16)Dong QX et al. Int Immunophamacol. 2018, 65: 413-421.
17)Maier M et al. Sci Trans Med. 2018, 10(470): eaah3924. doi: 10.1126/scitranslmed.aah3924.
TDP-43を標的とした最新の免疫療法
孤発性ALSの原因となるTDP-43では、細胞外分泌や細胞間に伝わるという報告もなされています18)が、詳細はまだよくわかっていません。
しかしながら、かつては技術的に難しかった、細胞内に蓄積した「異常構造を持つタンパク質」を除去する技術の開発が進められています(図5)。
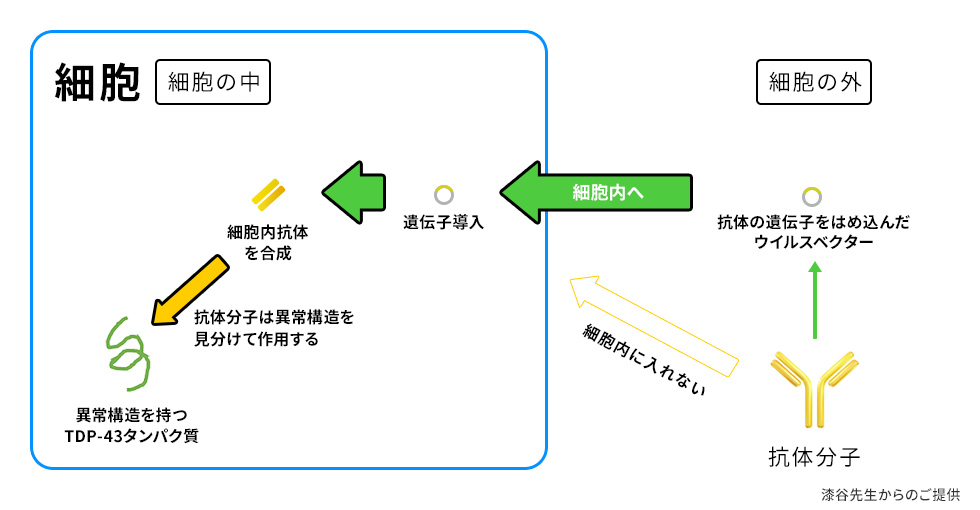
抗体をつくる遺伝子を何らかの方法で細胞内に導入する『遺伝子治療』の技術です。
ウイルスベクターという、遺伝物質を細胞内に輸送するようデザインされたツールを用いて、抗体の遺伝子を細胞内に導入し、細胞に抗体を合成させようとするものです。
導入する遺伝子に、分解・除去機能を付与しておくことで、細胞内で合成された抗体は、「異常構造を持つタンパク質」を認識し、分解・除去できます。現在、この手法はマウスによる実験で成功している段階です19, 20)。
ただし、今後の開発には安全性という大きな課題が残されています。
ウイルスベクターは、その名のとおりウイルス由来です。一度、細胞内に導入してしまうと、一生、その細胞にウイルス由来のものが居続けることになります。
現在の研究は、寿命の短いマウスで、安全性が得られているのみです。人に応用するには、霊長類モデルを開発し、何十年もの長い期間での安全性の確認が必須です。
大きな課題ではありますが、ALSと似た神経に変性が生じるアルツハイマー型認知症では、遺伝子改変を行った霊長類モデル(カニクイザル)を作ることに成功しています21)。また、別の研究ですが、ウイルスベクターに用いたウイルスを細胞内から除去する手段も検討されています22)。
これらの技術を応用していくことで、今後、孤発性ALS患者さんには、TDP-43を標的とした細胞内抗体の開発が進むと期待しています。
18)Nonaka T et al. Cell Rep. 2013, 4(1): 124-134.
19)Tamaki Y et al. Sci Rep. 2018, 8(1): 6030.
20)Pozzi S et al. J Clin Invest. 2019, 129(4): 1581-1595.
21)Seita Y et al. J Alzheimers Dis. 2020, 75(1): 45-60.
22)Tokunaga T et al. Antiviral Res. 2017, 143: 237-245.
核酸療法の登場など、他の研究も進行中
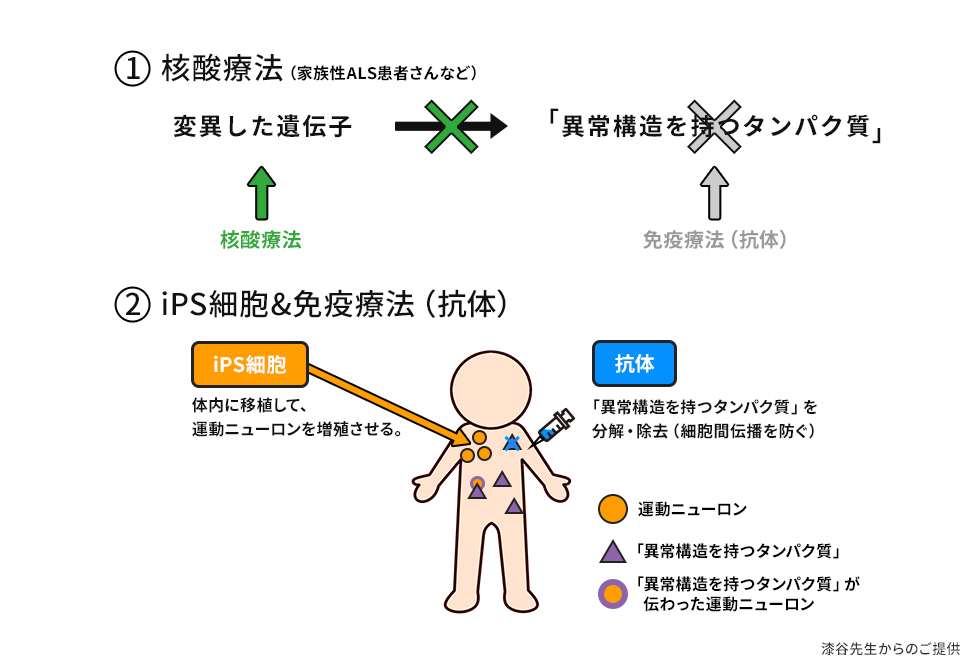
家族性ALS患者さんには、最近、技術の大きな発展があり、変異した遺伝子に働きかけ、「異常構造を持つタンパク質」を作らせないようにしようという、核酸療法が登場しています(図6)23)。
この核酸療法は、遺伝性の原因がある患者さんに対する、治療法です。
孤発性ALS患者さんの中にも、未だ発見されていない遺伝子変異が見つかったり、リスク遺伝子注2)の研究がさらに進めば、この治療法が使えるかもしれません。
注2) リスク遺伝子とは、その遺伝子があるかないかで、ある病気へのなりやすさが異なるものです。現在、孤発性ALSの発症に関わるリスク遺伝子を阻害すべく、核酸療法の開発が進められています(Kim G et al. Neuron. 2020, Sep 5; S0896-6273(20)30653-X. doi: 10.1016/j.neuron.2020.08.022. Online ahead of print.)。
また、SOD1に変異が生じている患者さんには、iPS細胞の移植と、免疫療法(抗体)の組み合わせによる、新たな治療戦略についての検討も始まっています(図6)24)。
iPS細胞移植は、運動ニューロンを移植し、体内で増殖させようとするものですが、増殖には何年も時間がかかりますし、移植した細胞に、「異常構造を持つタンパク質」が伝わってしまう可能性もあります。
一方、抗体療法は、毎月、背中に点滴を投与するなど、患者さんの負担が考えられます。
新たな治療戦略はこれら双方のデメリットを補い合い、メリットを活かせるのではないかと期待しています。
23)Miller T et al. N Engl J Med. 2020, 383(2): 109-119.
24)Hikiami R et al. 医学のあゆみ. 2020, 273(1): 44-49.
希望の突破口が次々と

長い間ALSは原因不明で、解決の手がかりが全くないことから、我が国の著明な神経科学者 が「完全犯罪」に例えて語ったほどでした。
しかし、今は、さまざまなALSの手がかりが見つかり、最新技術を用いたアプローチが次々と試みられています。今回、ご紹介した免疫療法だけでなく、他にいくつもの治療法の研究が並行して開発されています。
世界中の研究者が、一日も早く皆さんに朗報をお伝えできるよう、日々努力を続けています。
新たな治療法は必ず出てきます。
希望の未来が拓く過程を、ともに見守ってください。
(2020年11月 取材)
本コンテンツの情報は公開時点(2021年1月28日)のものです。
